高精度の光線-電子相関顕微鏡法の開発に成功
~様々な疾患における超微形態解析や機能解明への応用に期待~
順天堂大学大学院医学研究科神経疾患病態構造学講座の谷田以誠 先任准教授、内山安男 特任教授らの研究グループは、遠赤色蛍光タンパク質(*1)を用いた高精度の光線−電子相関顕微鏡法(In-resin CLEM*2)を開発しました。従来の蛍光タンパク質は、電子顕微鏡用試料作成時に蛍光が消失してしまうという問題点がありましたが、本法では、電子顕微鏡用の試料処理過程において蛍光を消失しない遠赤色蛍光タンパク質を同定したことで、同一試料で蛍光観察と電子顕微鏡観察が可能となり、光学顕微鏡による蛍光シグナルと電子顕微鏡による細胞小器官の超微細構造(*3)とを高精度に一致させることに成功しました。本研究成果により、癌細胞の浸潤や神経細胞の変性など、様々な疾患における超微形態解析や機能解明への応用が期待されます。本論文はScientific Reports誌のオンライン版に2020年7月9日付で公開されました。
本研究成果のポイント
背景
光線−電子相関顕微鏡法(CLEM)は、光学顕微鏡による蛍光像と電子顕微鏡像を相関させて画像を重ね合わせる手法です。蛍光タンパク質を用いて細胞や細胞小器官を標識することにより、組織や細胞内での蛍光の位置や強さを明らかにしながら、超微細構造を電子顕微鏡で解析することが可能となります。これまで蛍光観察には緑色蛍光タンパク質(ノーベル賞受賞者 下村 脩博士の発見)などが用いられていましたが、電子顕微鏡用試料作成時に蛍光が消失してしまう問題点がありました。また、従来のCLEMでは、蛍光観察の後に、電子顕微鏡用の化学固定処理・超薄切片調製を行う過程で化学的・物理的歪みが生じてしまうため、高精度の画像の重ね合わせによる解析を行うことは困難でした(図1)。そこで研究グループは、電子顕微鏡用試料作成時に蛍光タンパク質の蛍光を保持することができれば、電子顕微鏡レベルの薄さの試料(100nm厚の超薄切片)による高精度の光線−電子相関顕微鏡法(In-resin CLEM)が可能になると考え、本研究を行いました。
高精度のCLEMを可能にするためには、電子顕微鏡用の生体試料において、蛍光タンパク質の蛍光が保持されることが必須です。ところが、電子顕微鏡の生体試料作製過程では、細胞のタンパク質や生体膜を薬品で固定、脱水、樹脂への包埋(*4)・重合反応(*5)を行う必要があるため、これらの処理過程で蛍光タンパク質の多くは蛍光を発する能力を失ってしまいます。そこで、研究グループは蛍光能が最も消失する処理過程である生体膜の染色直後に着目し、細胞内で蛍光を保持できる蛍光タンパク質を探しました。その結果、数ある蛍光タンパク質の中で、遠赤色蛍光タンパク質のひとつが蛍光能を保持できることを見出しました。
次に、その遠赤色蛍光タンパク質を発現させた細胞に対して電子顕微鏡用の試料処理を行い、電子顕微鏡観察に使う100nm厚の超薄切片(ヒト細胞の直径は6〜25µm程度、1µmは1000nmなので、その60〜250分の1の厚さ)を作製し、蛍光顕微鏡(光学顕微鏡の一種)で観察したところ、細胞内に遠赤色の蛍光が観察できました。さらに、同じ超薄切片をそのまま電子顕微鏡でも観察することに成功しました。本手法により、同一の超薄切片での蛍光観察と電子顕微鏡観察が可能となったことで、これまで問題となっていた化学的・物理的歪みの問題が解消され、理論上は電子線および蛍光波長による差異のみしか残らないことになります(図1)。この発見により、極めて歪みの少ない高精度のCLEM(エポキシ樹脂包埋試料によるIn-resin CLEM)が可能となりました。そこで遠赤色蛍光タンパク質をミトコンドリア、ゴルジ体、小胞体の細胞小器官それぞれに発現させて、電子顕微鏡用の試料処理を行いました。その結果、蛍光観察で光る部位が、実際にミトコンドリア、ゴルジ体、小胞体であることを電子顕微鏡像で確認できました(図2)。
以上の結果により、電子顕微鏡用の樹脂包埋試料内で蛍光を発する遠赤色蛍光タンパク質を同定し、電子顕微鏡用試料における細胞小器官の高精度の光線−電子相関顕微鏡法(In-resin CLEM)を世界で初めて成功させました。
遠赤色蛍光タンパク質は緑色蛍光タンパク質とは異なり、生体組織を通過する時の蛍光のロスが少なく、生体組織の蛍光観察に適しています。多くの疾患やがんの浸潤などは組織内における細胞や細胞小器官の異常を伴うことが多いため、モデルマウスの実験で異常な細胞を遠赤色蛍光タンパク質で標識することにより、組織内の異常と変化をモニターできると同時に、電子顕微鏡レベルでの超微形態解析が可能になります。また、100nm厚の超薄切片における蛍光観察が可能となったために、これまでの蛍光顕微鏡のZ軸分解能*6(通常300〜500nm)を凌駕する解像度が得られることとなり、組織・細胞生物学分野でも大きな進展が期待されます。
今後、他の波長の蛍光タンパク質でも高精度の光線−電子相関顕微鏡法(In-resin CLEM)が可能となるように研究を展開し、マルチカラーIn-resin CLEMが可能となれば、脳における複雑な神経細胞間連携や神経細胞とグリア細胞間連携の解析など、多くの組織における細胞間連携の解析のみならず、様々な疾患の異常なタンパク質の局在・超微形態解析まで、幅広い応用が期待されます。
用語解説
*1 蛍光タンパク質:ある波長の光を吸収して、より長波長の蛍光を発するタンパク質。青色光を吸収して、緑色光を発するGFPの発見により、下村博士がノーベル賞受賞。
*2 光線−電子相関顕微鏡法(In-resin CLEM):同じ試料を蛍光顕微鏡で観察した後、電子顕微鏡で観察し、得られた蛍光像と電子顕微鏡像を比較・相関させる画像解析技術。
*3 超微細構造:電子顕微鏡により得られた生体試料の画像で得られる構造。光学顕微鏡の分解能が200-300 nm、超解像蛍光顕微鏡で60-70 nm程度に比べ、電子顕微鏡の分解能は0.2 nm程度なので、300−1000倍程度の微細な構造が電子顕微鏡解析により得られる。
*4 包埋:生体試料は柔らかいため、薄い切片を作成するために樹脂などで生体試料を固める操作。
*5 重合反応:モノマー(単量体)やポリマー(重合体)を結合をすることで、より大きなポリマーを合成する化学反応。
*6 Z軸分解能:顕微鏡観察の平面(X-Y軸断面という)観察に対して、垂直方向をZ軸と呼ぶ。この垂直方向の分解能をZ軸分解能と呼ぶ。3次元画像を得る場合には、Z軸の分解能が重要になる。
原著論文
本研究はScientific Reports誌に(2020年7月9日付)公開されます。
タイトル: Visualization of cytoplasmic organelles via in-resin CLEM using an osmium-resistant far-red protein.
タイトル(日本語訳): オスミウム酸耐性の遠赤色タンパク質を用いたin-resin CLEMによる細胞内オルガネラの可視化
著者:Isei Tanida, Soichiro Kakuta, Juan Alejandro Oliva Trejo, and Yasuo Uchiyama
著者(日本語表記):谷田以誠1、角田宗一郎1, 2、オリバ トレホ・アレハンドロ1 、内山安男1
著者所属: 1 順天堂大学大学院医学研究科神経疾患病態構造学講座、2 順天堂大学大学院医学研究科形態解析イメージング研究室
DOI: 10.1038/s41598-020-68191-z
本研究は国立研究開発法人日本医療研究開発機構(AMED)「老化メカニズム解明・制御プロジェクト」研究費 (17gm5010003)、日本学術振興会(JSPS)科研費(JP15K12749)、順天堂大学老人性疾患病態・治療研究センター研究奨励費の支援を受けて、実施されました。
- 同一試料で蛍光観察と電子顕微鏡観察を可能にする遠赤色蛍光タンパク質を発見
- 遠赤色蛍光タンパク質を用いた高精度の光線−電子相関顕微鏡法(In-resin CLEM)を開発
- 様々な疾患の細胞異常や細胞相互作用などの超微形態解析での幅広い応用へ期待
背景
光線−電子相関顕微鏡法(CLEM)は、光学顕微鏡による蛍光像と電子顕微鏡像を相関させて画像を重ね合わせる手法です。蛍光タンパク質を用いて細胞や細胞小器官を標識することにより、組織や細胞内での蛍光の位置や強さを明らかにしながら、超微細構造を電子顕微鏡で解析することが可能となります。これまで蛍光観察には緑色蛍光タンパク質(ノーベル賞受賞者 下村 脩博士の発見)などが用いられていましたが、電子顕微鏡用試料作成時に蛍光が消失してしまう問題点がありました。また、従来のCLEMでは、蛍光観察の後に、電子顕微鏡用の化学固定処理・超薄切片調製を行う過程で化学的・物理的歪みが生じてしまうため、高精度の画像の重ね合わせによる解析を行うことは困難でした(図1)。そこで研究グループは、電子顕微鏡用試料作成時に蛍光タンパク質の蛍光を保持することができれば、電子顕微鏡レベルの薄さの試料(100nm厚の超薄切片)による高精度の光線−電子相関顕微鏡法(In-resin CLEM)が可能になると考え、本研究を行いました。
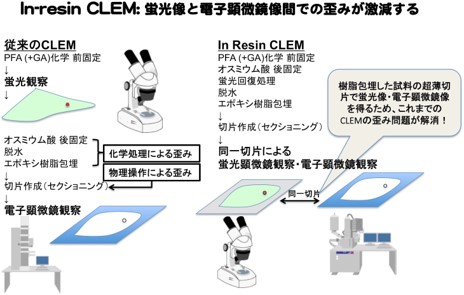 図1:In-resin CLEMにより、蛍光像と電子顕微鏡像での歪みが激減する
図1:In-resin CLEMにより、蛍光像と電子顕微鏡像での歪みが激減する
高精度のCLEMを可能にするためには、電子顕微鏡用の生体試料において、蛍光タンパク質の蛍光が保持されることが必須です。ところが、電子顕微鏡の生体試料作製過程では、細胞のタンパク質や生体膜を薬品で固定、脱水、樹脂への包埋(*4)・重合反応(*5)を行う必要があるため、これらの処理過程で蛍光タンパク質の多くは蛍光を発する能力を失ってしまいます。そこで、研究グループは蛍光能が最も消失する処理過程である生体膜の染色直後に着目し、細胞内で蛍光を保持できる蛍光タンパク質を探しました。その結果、数ある蛍光タンパク質の中で、遠赤色蛍光タンパク質のひとつが蛍光能を保持できることを見出しました。
次に、その遠赤色蛍光タンパク質を発現させた細胞に対して電子顕微鏡用の試料処理を行い、電子顕微鏡観察に使う100nm厚の超薄切片(ヒト細胞の直径は6〜25µm程度、1µmは1000nmなので、その60〜250分の1の厚さ)を作製し、蛍光顕微鏡(光学顕微鏡の一種)で観察したところ、細胞内に遠赤色の蛍光が観察できました。さらに、同じ超薄切片をそのまま電子顕微鏡でも観察することに成功しました。本手法により、同一の超薄切片での蛍光観察と電子顕微鏡観察が可能となったことで、これまで問題となっていた化学的・物理的歪みの問題が解消され、理論上は電子線および蛍光波長による差異のみしか残らないことになります(図1)。この発見により、極めて歪みの少ない高精度のCLEM(エポキシ樹脂包埋試料によるIn-resin CLEM)が可能となりました。そこで遠赤色蛍光タンパク質をミトコンドリア、ゴルジ体、小胞体の細胞小器官それぞれに発現させて、電子顕微鏡用の試料処理を行いました。その結果、蛍光観察で光る部位が、実際にミトコンドリア、ゴルジ体、小胞体であることを電子顕微鏡像で確認できました(図2)。
以上の結果により、電子顕微鏡用の樹脂包埋試料内で蛍光を発する遠赤色蛍光タンパク質を同定し、電子顕微鏡用試料における細胞小器官の高精度の光線−電子相関顕微鏡法(In-resin CLEM)を世界で初めて成功させました。
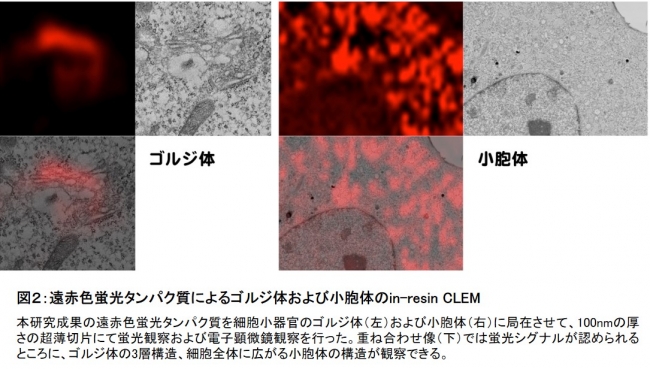 図2:遠赤色蛍光タンパク質によるゴルジ体および小胞体のin-resin CLEM
図2:遠赤色蛍光タンパク質によるゴルジ体および小胞体のin-resin CLEM
遠赤色蛍光タンパク質は緑色蛍光タンパク質とは異なり、生体組織を通過する時の蛍光のロスが少なく、生体組織の蛍光観察に適しています。多くの疾患やがんの浸潤などは組織内における細胞や細胞小器官の異常を伴うことが多いため、モデルマウスの実験で異常な細胞を遠赤色蛍光タンパク質で標識することにより、組織内の異常と変化をモニターできると同時に、電子顕微鏡レベルでの超微形態解析が可能になります。また、100nm厚の超薄切片における蛍光観察が可能となったために、これまでの蛍光顕微鏡のZ軸分解能*6(通常300〜500nm)を凌駕する解像度が得られることとなり、組織・細胞生物学分野でも大きな進展が期待されます。
今後、他の波長の蛍光タンパク質でも高精度の光線−電子相関顕微鏡法(In-resin CLEM)が可能となるように研究を展開し、マルチカラーIn-resin CLEMが可能となれば、脳における複雑な神経細胞間連携や神経細胞とグリア細胞間連携の解析など、多くの組織における細胞間連携の解析のみならず、様々な疾患の異常なタンパク質の局在・超微形態解析まで、幅広い応用が期待されます。
用語解説
*1 蛍光タンパク質:ある波長の光を吸収して、より長波長の蛍光を発するタンパク質。青色光を吸収して、緑色光を発するGFPの発見により、下村博士がノーベル賞受賞。
*2 光線−電子相関顕微鏡法(In-resin CLEM):同じ試料を蛍光顕微鏡で観察した後、電子顕微鏡で観察し、得られた蛍光像と電子顕微鏡像を比較・相関させる画像解析技術。
*3 超微細構造:電子顕微鏡により得られた生体試料の画像で得られる構造。光学顕微鏡の分解能が200-300 nm、超解像蛍光顕微鏡で60-70 nm程度に比べ、電子顕微鏡の分解能は0.2 nm程度なので、300−1000倍程度の微細な構造が電子顕微鏡解析により得られる。
*4 包埋:生体試料は柔らかいため、薄い切片を作成するために樹脂などで生体試料を固める操作。
*5 重合反応:モノマー(単量体)やポリマー(重合体)を結合をすることで、より大きなポリマーを合成する化学反応。
*6 Z軸分解能:顕微鏡観察の平面(X-Y軸断面という)観察に対して、垂直方向をZ軸と呼ぶ。この垂直方向の分解能をZ軸分解能と呼ぶ。3次元画像を得る場合には、Z軸の分解能が重要になる。
原著論文
本研究はScientific Reports誌に(2020年7月9日付)公開されます。
タイトル: Visualization of cytoplasmic organelles via in-resin CLEM using an osmium-resistant far-red protein.
タイトル(日本語訳): オスミウム酸耐性の遠赤色タンパク質を用いたin-resin CLEMによる細胞内オルガネラの可視化
著者:Isei Tanida, Soichiro Kakuta, Juan Alejandro Oliva Trejo, and Yasuo Uchiyama
著者(日本語表記):谷田以誠1、角田宗一郎1, 2、オリバ トレホ・アレハンドロ1 、内山安男1
著者所属: 1 順天堂大学大学院医学研究科神経疾患病態構造学講座、2 順天堂大学大学院医学研究科形態解析イメージング研究室
DOI: 10.1038/s41598-020-68191-z
本研究は国立研究開発法人日本医療研究開発機構(AMED)「老化メカニズム解明・制御プロジェクト」研究費 (17gm5010003)、日本学術振興会(JSPS)科研費(JP15K12749)、順天堂大学老人性疾患病態・治療研究センター研究奨励費の支援を受けて、実施されました。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザーログイン既に登録済みの方はこちら
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
- 種類
- その他
- ダウンロード
