細菌の病原性などに関わる糖鎖「OPG」の新規の生合成酵素を発見
~新たな創薬ターゲットとなる可能性~
【研究の要旨とポイント】
「OPG」は、グラム陰性菌の病原性や共生能にかかわる重要な糖鎖です。しかし、これまでOPGの生合成にはたらく酵素については解明が進んでいませんでした。
OPG生合成に必須と考えられる遺伝子opgG、opgDの産物がβ-1,2-グルカン分解酵素(β-1,2-グルカナーゼ)であることを見出しました。これらは、他の糖質加水分解酵素(GH)とはアミノ酸配列、構造ともに類似性を示さないことから、新規のGHファミリー(GH186)が創設されました。
GH186は、将来的には病原菌の病原性を阻害するための創薬ターゲットとなる可能性が考えられます。
【研究の概要】
OPG(Osmo-regulated Periplasmic Glucans)は、グラム陰性菌(*1)が細胞外やペリプラズム領域(*2)に合成する多糖です。これまでの研究から、この糖鎖が細菌の病原性や共生能に深くかかわることが知られています。
東京理科大学大学院創域理工学研究科生命生物科学専攻の元内省氏(博士後期課程1年)、同大学創域理工学部生命生物科学科の中島将博准教授、産業技術総合研究所人工知能研究センターの小林海渡氏、新潟大学農学部農学科の中井博之准教授らの研究グループは、このOPGの糖鎖骨格合成に必須と考えられる遺伝子opgGおよびopgDの産物について解析し、これらがβ-1,2-グルカン(*3)を基質とする糖質加水分解酵素(Glycoside hydrolase:GH)であることを見出しました。
多くの病原菌において、遺伝子opgGの機能を欠失させるとOPGが合成されず、病原性が失われることが知られています。しかし、その産物であるタンパク質OpgGの生化学的機能については遺伝子が発見されてから30年以上もの間、解明されていませんでした。そこで、本研究ではOpgG、およびそのパラログ(*4)であるOpgDについて、機能構造解析を行いました。すると、OpgGおよびOpgDは、β-1,2-グルカンを加水分解するβ-1,2-グルカナーゼであることが明らかになりました。特筆すべきことに、これらは既知のGHファミリー(*5)とはアミノ酸配列、構造が全く異なるため、新しいタイプの酵素群として新規のGHファミリー(GH186)が創設されました。さらに、OpgDはGHファミリーには先例のない反応メカニズムをもつことがわかりました。
本研究で示されたOPG生合成経路に関する新たな知見は、学術的に意義深いだけでなく、今回同定された新規のGHファミリーは、将来的には、グラム陰性病原菌の病原性を阻害するための構造ベース創薬のターゲットとなる可能性も考えられます。
本研究成果は、2023年9月21日に国際学術誌「Communications Biology」にオンライン掲載されました。
【研究の背景】
OPGはグルカンの骨格構造により4つのグループに分類されます。今回、研究グループが着目したのは、多くの重要なヒト病原菌・植物病原菌を含むγプロテオバクテリア(*6)が合成するとされる直鎖状のOPGです。これは、β-1,2-グルカンを主鎖とし、β-1,6-グルコシド結合による側鎖をもちます(図1)。
糖鎖は、生物にとって、さまざまな役割をもつ重要な物質です。糖鎖の構造は非常に多様で複雑であるため、その合成や分解には多くの酵素が関与します。そのため、糖鎖の機能や合成・分解プロセスの全容は未解明、未開拓の部分が多く残されています。しかし開拓の出発材料となる糖鎖の多くはそれ自体が希少で実質的に入手できないことが多く、これが糖鎖に関連する新しい酵素の探索を難しくしています。中島准教授は、「そうした困難な領域を探索するパイオニアでありたい」というモチベーションをもとに、これまで研究を行ってきました。
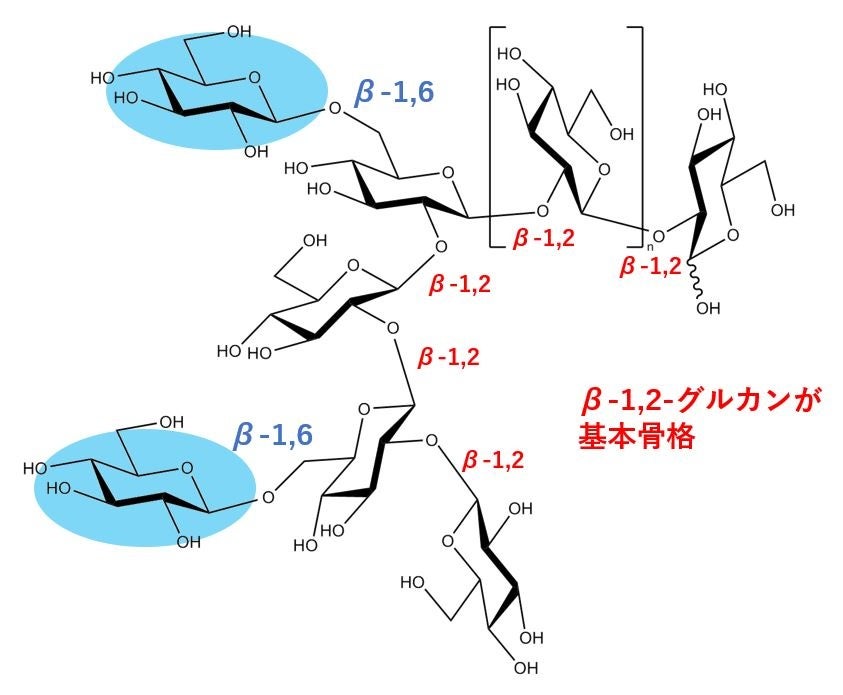
図1 大腸菌由来のOPGの構造(Nakajima, M. (2022) β-1,2-Glucans and associated enzymes. Biologia 78, 1741–1757. のFig. 1cを一部改変)。側鎖であるβ-1,6-グリコシド結合の位置は詳細には解明されていない。
【研究結果の詳細】
本研究では、大腸菌由来の組換えOpgDとOpgGを、大腸菌を用いて生産・精製しました。OpgDをあらゆる多糖基質に作用させたところ、研究グループが独自に調製した希少な多糖β-1,2-グルカンのみに対して加水分解が起こり、ソホロオリゴ糖(β-1,2-グルコオリゴ糖)が生成することが分かりました。さらに、反応速度論的解析からOpgDがβ-1,2-グルカンに対して十分に高い加水分解速度を示すことを明らかにしました。これらのことから、OpgDの真の機能がβ-1,2-グルカナーゼであることが証明され、OPGの生合成の過程で鎖長を調節している可能性が示唆されました。一方で、OpgGは同様の加水分解活性を示すものの、その効率はOpgDよりも大幅に低いことがわかりました。OpgGがβ-1,2-グルカナーゼ以外の真の機能をもつかは今後の研究が必要です。OpgDとOpgGは、既知のいずれのGHファミリーの酵素ともアミノ酸配列が類似していないことから、OpgDとOpgGの類似酵素群の新しい分類として新規のGHファミリー(GH186)が創設されました。
新規なGHファミリーを発見した場合、反応メカニズムを解明することはファミリー全体の特徴を知るうえで重要です。また、特にこのGH186ファミリーは病原菌の病原性に関わることから、立体構造や反応メカニズムに基づいた阻害剤が設計できれば、農薬、医薬品の創製につながる可能性があります。そこで反応メカニズム解明の第一段階である「大まかな反応の種類の分類」を行いました。GHファミリーの反応メカニズムは、主に「アノマー保持型(*7)」と「アノマー反転型(*7)」に大別されます。そこで、OpgDによるβ-1,2-グルカン分解中の反応溶液の旋光度変化を測定しました。その結果、OpgDはアノマー反転型の反応機構に従うことがわかりました。これに基づき、さらに詳細な反応機構を解明するために、X線結晶構造解析(*8)を行いました。
OpgDの結晶構造解析
まず、リガンドフリー(基質と結合していない状態)のOpgDの全体構造を、X線結晶構造解析法により決定しました。OpgDの二量体構造中には2つの大きな裂け目(クレフト)があり、このクレフト部分が基質結合部位と考えられます。興味深いことにOpgDの構造は他の既存のGHファミリーのどれとも構造類似性を示さない、真に独立したユニークなGHファミリーということが分かりました。
次に、β-1,2-グルカン加水分解メカニズムを立体構造に基づいて説明するため、OpgDのD388N変異体を用いて、OpgDのミカエリス複合体構造(*9)を決定しました。このOpgDのミカエリス複合体構造の観察により、反応メカニズムに関する仮説を立てることができました。この仮説をより信頼性の高いものにするために変異酵素解析などをおこない、図2に示すような反応メカニズムが提唱されました。サブサイト(*10)−1と+1の間に位置する触媒残基D388が、基質グリコシド結合の酸素にプロトンを供与することで、この結合の分解を促します。また、もう一つの触媒残基D300が、2つの水分子(Wat2、Wat3)と1つの基質のヒドロキシ基(OH基)を介して、求核水(Wat1)を活性化します。推定された反応機構は、このように他のGHファミリーでは例を見ないほどに長いプロトン移動経路をもっていました。
さらに研究グループはこの一つの酵素だけでなく、GH186ファミリーに属する他の酵素群の機能に関しても考察しています。提唱された長いプロトン移動経路を安定化する構造領域は、GH186ファミリーの中で非常に多様性に富んでいることが分かりました。実際にこの領域の違いが、OpgGの非効率な加水分解活性の要因となっています。このことを踏まえ、元内さんは「GH186には、今回解明したOpgDとは異なる反応メカニズムをもつ酵素も存在する可能性が考えられます。もしかしたら、自然界のOPGの構造多様性を実現するために、GH186ファミリーは分子進化により多様化してきたのかもしれません」と述べています。今回新規に見つかったGHファミリーは、OPGの直接的な合成に関わる酵素です。その詳細な機能を解明できたことで、構造をもとにした創薬が可能になることが期待されます。
※ 本研究は、JST次世代研究者挑戦的研究プログラム(JPMJSP2151)の助成を受けて実施したものです。
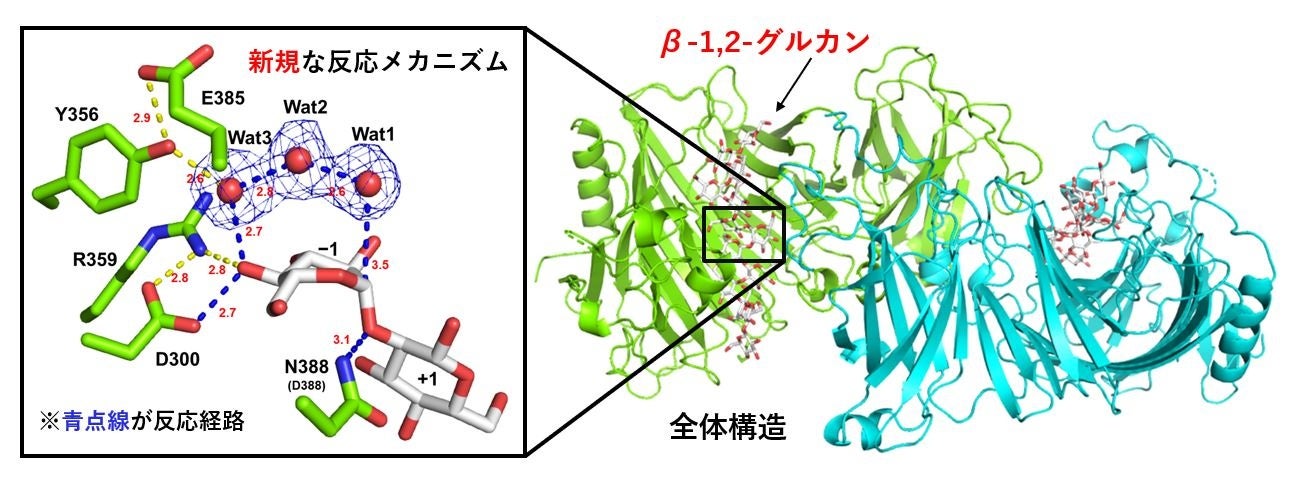
図2 X線結晶構造解析法により取得したβ-1,2-グルカンが結合したOpgDの構造。Wat1、Wat2、Wat3は水分子を示す(Wat1:求核水)。緑色がOpgD、白色がβ-1,2-グルカンの骨格を示す。
【用語】
*1 グラム陰性菌
グラム染色液に染まらない細菌の一群で、内膜と外膜の2枚の細胞膜に包まれ、薄いペプチドグリカン層をもつことを特徴とする。
*2 ペリプラズム領域
グラム陰性菌がもつ、内膜と外膜に挟まれた領域。
*3 β-1,2-グルカン
グルコースがβ-1,2-結合というめずらしい様式で結合した多糖。環状構造をもつβ-1,2-グルカンは、疎水性の化合物と複合体を形成することで、水に溶けやすくさせる性質などをもつことから、薬学や食品科学分野への応用が期待されるが、機能性に関する研究はまだ十分に進んでいない。
*4 パラログ
遺伝子重複により生じた類似遺伝子。大腸菌由来のOpgGとOpgDでは、32.9%のアミノ酸配列が一致する。
*5 GHファミリー
糖質加水分解酵素(Glycoside Hydrolase)ファミリーの略。糖鎖を加水分解する酵素群のなかで、アミノ酸配列の類似性が高い一群。
*6 γプロテオバクテリア
モデル生物である大腸菌をはじめとして、緑膿菌などの病原菌や、Dickeya dadantii、Pseudomonas syringaeなどの植物病原菌を含む細菌の一群。
*7 アノマー保持型、アノマー反転型
グリコシド結合を加水分解する酵素反応のうち、基質のアノマー型と生成物のアノマー型が同じものをアノマー保持型、異なるものをアノマー反転型という。アノマーとは、糖が5員環(フラノース)または6員環(ピラノース)の環状構造をとるときに新たに生じるヒドロキシ基の向きに由来する立体異性体の関係を示す用語。
*8 X線結晶構造解析法
タンパク質の立体構造を決定する手法。目的とするタンパク質の結晶にX線を照射することで得られるデータから、三次元構造を導き出す。
*9 ミカエリス複合体構造
酵素反応が起こる直前の状態の酵素基質複合体構造を示す。
*10 サブサイト
基質を構成する個々の部位と結合する酵素の部位のこと。糖鎖の合成分解に関わる酵素の場合、基質の切断部位から数えて還元末端側へ+1、+2、+3、逆の方向へは−1、−2、−3、と順番にサブサイト番号が定義される。
【論文情報】
雑誌名:Communications Biology
論文タイトル:Identification of enzymatic functions of osmo-regulated periplasmic glucan biosynthesis proteins from Escherichia coli reveals a novel glycoside hydrolase family
著者:Sei Motouchi, Kaito Kobayashi, Hiroyuki Nakai and Masahiro Nakajima
DOI:10.1038/s42003-023-05336-6
URL:https://doi.org/10.1038/s42003-023-05336-6
【発表者】
元内省 東京理科大学大学院 創域理工学研究科 生命生物科学専攻 博士後期課程1年 <筆頭著者>
小林海渡 産業技術総合研究所 人工知能研究センター 産総研特別研究員
中井博之 新潟大学 農学部 農学科 准教授
中島将博 東京理科大学 創域理工学部 生命生物科学科 准教授 <責任著者>
【研究に関する問い合わせ先】
東京理科大学 創域理工学部 生命生物科学科 准教授
中島 将博(なかじま まさひろ)
E-mail:m-nakajima【@】rs.tus.ac.jp
新潟大学 農学部 農学科 准教授
中井 博之(なかい ひろゆき)
E-mail:nakai【@】agr.niigata-u.ac.jp
【報道・広報に関する問い合わせ先】
東京理科大学 経営企画部 広報課
TEL:03-5228-8107
FAX:03-3260-5823
E-mail:koho【@】admin.tus.ac.jp
新潟大学 広報事務室
TEL:025-262-7000
E-mail:pr-office【@】adm.niigata-u.ac.jp
【@】は@にご変更ください。
このプレスリリースには、メディア関係者向けの情報があります
メディアユーザー登録を行うと、企業担当者の連絡先や、イベント・記者会見の情報など様々な特記情報を閲覧できます。※内容はプレスリリースにより異なります。
すべての画像
